Source:羧基磁珠Author:admin Addtime:2019/01/16 Click:
过程的优化要考虑多种因素:基质相互作用,洗脱条件,放大,法规,药物安全,工艺稳定性及经济性等。下面四个纯化方案(Fig3.4)可以作为大多数蛋白和核酸纯化起始条件,减少你研发时间。我们将详细介绍每个方案的关键点。
化学兼容性
所有缓冲液中不能含柠檬酸或 EDTA,这些螯合剂会降解 CHT。CHT 在含有钙和磷酸根存在,pH6.5-14 溶液中,可以兼容以下试剂:

2M NaOH*
6 M Guanidine-HCl
8M Urea
100% acetonitrile
100% ethanol/methanol
1%SDS or other surfactants (not calcium compatible)
4 M NaCl
1 M potassium phosphate**
0.5M sodium phosphate**
*No Ca or PO4 required ** No Ca required
3.3.2 洗脱
在洗脱过程中,缓冲液溶液盐浓度,缓冲液种类或其他元素的变化都可能导致流动相中 pH 的短暂变化。这种现象主要是流动相中的离子与 CHT 表面的磷酸基团相互作用的结果。pH 的漂移程度主要取决于离子的交换的程度。
3.3.3 Co-Buffers 使用

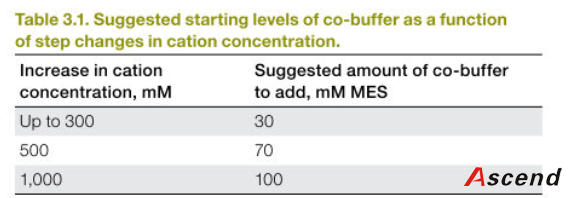
尽管添加 Co-buffer 之后,pH 下降的幅度大大减少了,减少了 CHT暴漏在低 pH 环境的时间。这将会大大提高 CHT 的使用次数。Co-buffer使用量随着洗脱的条件而变化。Table3.1 给出了一些起始 Co-buffer浓度建议。
备注:对许多 Co-buffer,首先以酸形式被添加,溶液用 NaOH 滴定到最终 pH。 如果在 Co-buffer 研究之前洗脱盐浓度已经确定,那么就需要减少洗脱溶液中 NacCl 的量,因为 Co-buffer 中和过程中会产生一些盐。
3.3.4 SNS
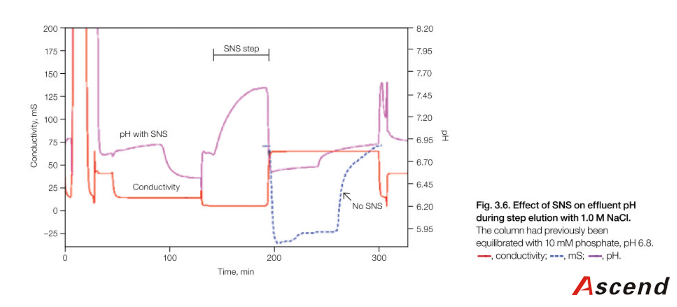
理想状态下,如果所有 CHT 表面的质子在洗脱前能够被中性的阳离子替换而不影响珠子的性能,这样在洗脱过程中阳离子浓度的增加就不会对 pH 影响。Bio-rad 根据这个原理发明了一种称为表面中和溶液(SNS)。简而言之,就是在洗脱之前增加一个弱碱洗脱步骤。见 Figure3.6. 典型的过程是
用 25mM Tris, 25Mm NaCl, 5Mm phosphate,pH7.75 清洗 6-8CV。
Tris 在整个过程中维持整个溶液微碱性,提供大量的氢氧根,与释放的质子迅速结合水。这种溶液已经在 20*20cm 的柱子上证明能够大幅 提 高 柱 子 的 寿 命 。 许 多 别 的 溶 液 , 如 Arginie,lysine ,histidine,PIPES,HEPES,ACES MOPS,MOPSO,在 3.2cm 直径柱子也显示有效的提高柱子寿命。
单抗研究显示,与传统方法比较,使用 SNS 后,产品质量(产量,洗脱峰位置,聚合体含量,DNA,HCP)都一样。除此之外,就测试抗体发现,对于使用 SNS 40 次后载量没有发生改变。
在一些研究中,酸性蛋白会在 SNS 步骤中被洗脱下来。可以对洗脱液质量做个鉴定确定是否可以直接使用 SNS 作为洗脱缓冲液。
3.3.5 钙离子
在 3.2.1 提到,钙离子也可以增加 CHT 柱子寿命。通过测量平衡液,上样和洗脱液中的钙离子浓度来决定添加钙离子的数量。这种测定可以通过非蛋白样品在小柱子运行多次获得有效的数值。测试每个样品大概需要 10min,直接通过标准的比色法分析获得,详细见附录 A2.96孔板也可以利用,具
体可以联系 Bio-rad.因为钙和磷酸在溶液状态会发生沉淀,确保钙的浓度在缓冲液中低于可溶性限度。钙离子有很好稳定能力,可以添加到任何钙离子泄露的溶液中。对于再生和清洗溶液中可以不需要添加钙离子。
3.3.6 磷酸根
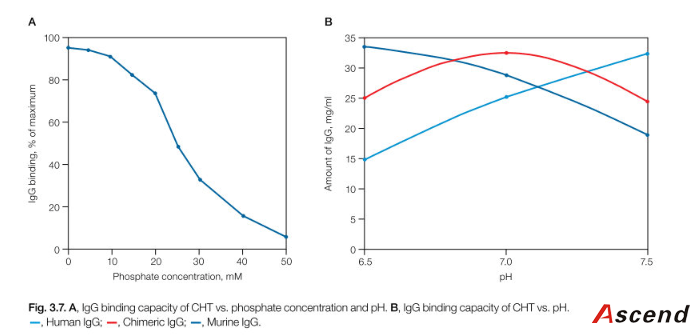
在 3.2.1 提到,磷酸根可以提高 CHT 的坚固性。通常,所有缓冲液都应该包含 5mM 磷酸盐。当缓冲液 pH 大于 7.0,磷酸盐浓度可以降低到 2mM.高于 5mM 磷酸盐浓度可能会降低蛋白的结合。见 Figure 3.7,50Mm MES 缓冲溶液中随着磷酸盐浓度增加 CHT 的载量随之减低。
3.3.7 微量金属元素污染
CHT 可以与溶液中微量金属元素结合,如铁离子。金属元素污染可能来源于样品,缓冲液和盐,生产用水,或者腐蚀的不锈钢。随着微量金属元素的沉积,柱子上部就形成了一有色层。如果出现了这个问题,可以再过滤之前用 CHT 预处理缓冲液,或者在上样前安装一根 CHT 保
护柱。也可以添加微量的钙饱和 EDTA,具体更多细节请联系 Bio-Rad.
3.3.8磷酸盐制备
在所有缓冲液中制备都需要用含水磷酸盐。不能使用无水磷酸盐,因为这些盐的制造过程会导致焦磷酸盐产生。焦磷酸盐会抑制一些大分子的结合和减少 CHT 的选择性。配置过程中避免 pH 反滴定,因为这会增加电导和减少目的蛋白结合。避免使用十二水化合物,因为十二水化合物会自然会降解
为七水化合物。
如果钙使用过量,就会与 CHT 的磷酸根位点结合,同时会与再生的磷酸盐缓冲液形成沉淀。
3.3.9 其他清洗
如果洗脱液中钙离子水平高于 10ppm,在高磷酸盐洗脱之前用 pH7.5-8.0 的低磷酸盐缓冲液清洗 3 个柱体积。同时,在涉及高磷酸和高 NaOH 溶液之间步骤增加 0.5CV 清洗步骤。
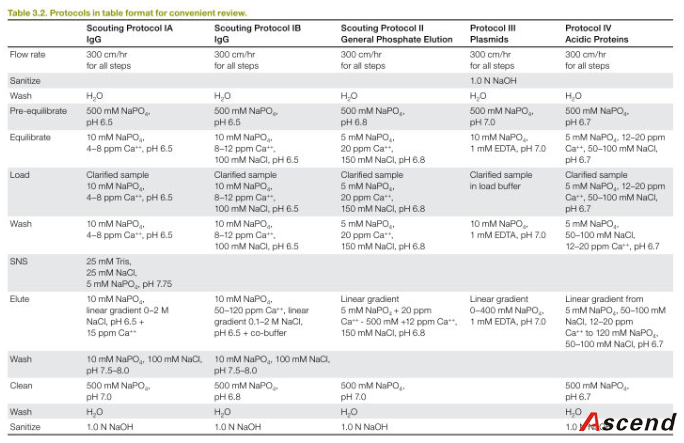
3.3.10 工艺开发 IA:lgG 3.3.11 工艺开发 IB:lgG

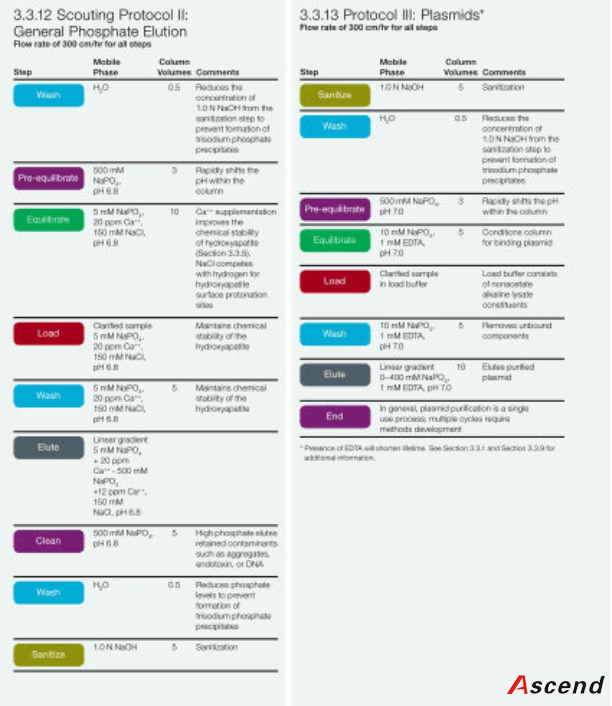
3.3.12 工艺开发:磷酸盐洗脱
3.3.13 工艺开发:质粒
3.3.14 工艺开发:酸性蛋白

3.3.15 条件摸索
目的蛋白通常用磷酸盐梯度洗脱。根据最初的洗脱结果调解线性洗脱的梯度。洗脱也可以用阶段洗脱或流穿模式。通常,蛋白的保留时间随着 PI 的增高而增强。
3.3.16 工艺优化
1 选择最佳的缓冲液试剂,确保添加一定量的钙和磷酸盐维持 CHT 基质稳定;
2 样品的离子强度应该与起始平衡缓冲液一致。 稀释,超滤或者用
Bio-Gel P-6DG 脱盐等方法都可以使用。
3 对于层析缓冲液,在使用前用 0.2-0.45um 过滤。
4 如果 500mM 磷酸钠不能洗脱目的蛋白(极少),可以尝试高浓度的磷酸钾。
5 如果洗脱峰不够尖,尝试使用 10CV 线性洗脱。
6 可以把线性洗脱转化为阶段洗脱。
7 用 5mM 磷酸盐浓度下得到的最大载量决定最佳 pH
羟基磷灰石微球,HAP,CHT :www.ex-dna.com








